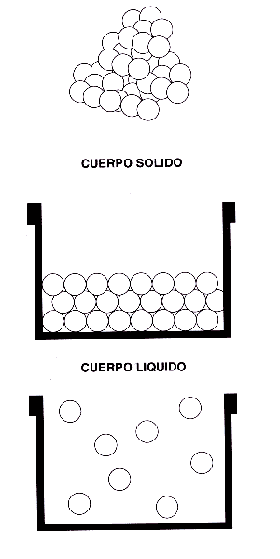
Como sabemos, la materia puede presentarse en tres estados distintos: SÓLIDO, LIQUIDO y GASEOSO, caracterizándose el estado sólido por tener forma y volumen propios, el estado líquido por tener volumen propio y poder variar su forma, y el estado gaseoso por no tener forma ni volumen propios.
Desde el punto de vista molecular, el estado sólido viene definido por el hecho de que las fuerzas de atracción de las moléculas prevalecen sobre las fuerzas de repulsión de las mismas, mientras que en el estado líquido hay un equilibrio entre ambas fuerzas, lo que determina que las moléculas puedan deslizarse libremente unas sobre otras - carencia de forma propia - pero sin alejarse entre sí, causa por la que conserva su volumen.
Por lo que se refiere al estado gaseoso, las fuerzas de repulsión son mayores que las de atracción, de tal modo que las moléculas pueden moverse libremente en todas direcciones, lo que determina su falta de forma propia; este movimiento libre y desordenado de las moléculas de una masa gaseosa hace que tampoco tenga volumen propio, volumen que se ve limitado únicamente por las paredes del recipiente que lo contiene.

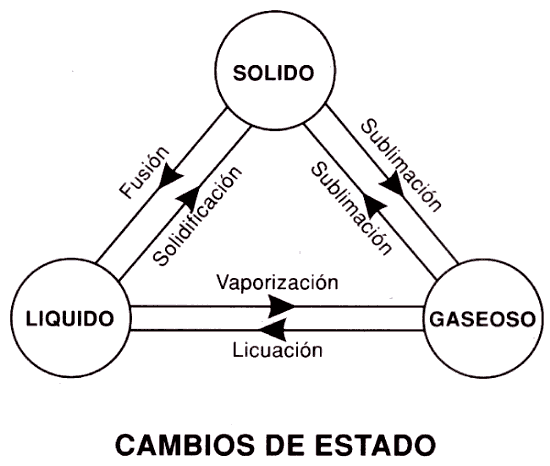
Una sustancia puede pasar del estado sólido al líquido, y de éste al gaseoso, siempre que se comunique a sus moléculas la energía suficiente apra equilibrar primero - estado líquido - y vencer después - estado gaseoso - las fuerzas de cohesión de sus moléculas.
Esta energía se suministra generalmente en forma de calor, dando lugar a los denominados cambios de estado progresivos, que son:
| FUSIÓN: | Paso de sólido a líquido. |
|---|---|
| VAPORIZACIÓN: | Paso de líquido a gas. |
| SUBLIMACIÓN: | Paso de sólido a gas. |
Los cambios de estado provocados por la pérdida de calor tiene lugar en sentido inverso a los anteriores; se denominan cambios de estado regresivos, y son:
| SOLIDIFICACIÓN: | Paso de líquido a sólido. |
|---|---|
| LICUACIÓN: | Paso de gas a líquido. |
| SUBLIMACIÓN: | Paso de gas a sólido. |
Los dos tipos de sublimación, esto es, el cambio de sólido a gas o a la inversa, sin pasar por el estado líquido, son fenomenos poco frecuentes, de los que no nos ocuparemos.
El calor añadido o extraído para los cambios de estado a partir de la ruptura estructural, se denomina CALOR LATENTE, puesto que no produce variación en la temperatura.
El ejemplo más natural lo podemos ver en el agua.
La temperatura y la presión a que están expuestas las sustancias determinan si se encuentran en estado sólido, líquido o gaseoso.
Sustancias diferentes tienen diferentes puntos de solidificación, de fusión, evaporización, etc.
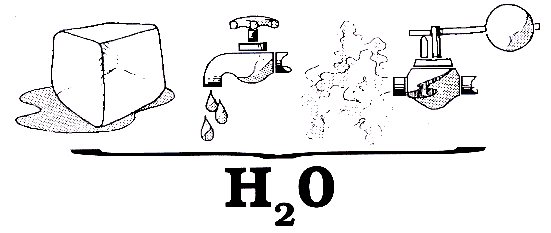
La cantidad de calor que se da o se quita a una sustancia para que se cambie de estado se llama calor latente.
Mientras un cuerpo cambia de estado, su temperatura permanece constante.
El agua hierve a la presión atmosférica de 100 °C.
Si la presión desciende por debajo de la atmosférica, el punto de ebullición del agua será más bajo que 100 °C.
Consecuentemente, si la presión sube por encima de la atmosférica, el agua hierve a más de 100 °C.
Al igual que le sucede al agua, esto es válido para todos los líquidos.
El agua en su punto de ebullición se llama también líquido saturado.
Fuente de información:
CURSO DE AIRE ACONDICIONADO
